At studere de processer, der forekommer i statistiske systemer, er kompliceret af den minimale størrelse af partikler og deres enorme antal. Det er praktisk t alt umuligt at overveje hver partikel separat, derfor introduceres statistiske mængder: partiklernes gennemsnitlige hastighed, deres koncentration, partikelmasse. Formlen, der karakteriserer systemets tilstand, under hensyntagen til mikroskopiske parametre, kaldes den grundlæggende ligning for den molekylær-kinetiske teori for gasser (MKT).
Lidt om den gennemsnitlige partikelhastighed
Bestemmelse af partiklernes hastighed blev først udført eksperimentelt. Et velkendt eksperiment fra skolens læseplan, udført af Otto Stern, gjorde det muligt at skabe en idé om partikelhastigheder. Under eksperimentet blev bevægelsen af sølvatomer i roterende cylindre studeret: først i en stationær tilstand af installationen, derefter når den roterede med en bestemt vinkelhastighed.
Som et resultat blev det fundet, at hastigheden af sølvmolekyler overstiger lydens hastighed og er 500 m/s. Faktum er ret interessant, da det er svært for en person at føle sådanne bevægelseshastigheder af partikler i stoffer.
Ideel gas
Fortsæt forskningDet synes kun muligt i et system, hvis parametre kan bestemmes ved direkte målinger ved hjælp af fysiske instrumenter. Hastighed måles med et speedometer, men ideen om at fastgøre et speedometer til en enkelt partikel er absurd. Kun en makroskopisk parameter forbundet med partikelbevægelse kan måles direkte.
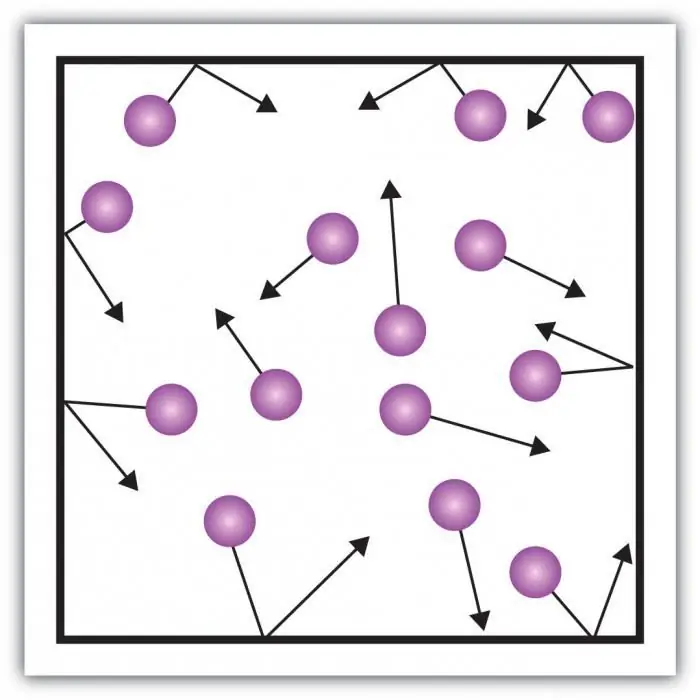
Overvej gastryk. Trykket på karrets vægge skabes af påvirkningerne af gasmolekylerne i karret. Det særlige ved den gasformige tilstand af stof er i tilstrækkeligt store afstande mellem partiklerne og deres lille interaktion med hinanden. Dette giver dig mulighed for direkte at måle dets tryk.
Ethvert system af interagerende kroppe er karakteriseret ved potentiel energi og kinetisk bevægelsesenergi. Ægte gas er et komplekst system. Variabiliteten af potentiel energi er ikke egnet til systematisering. Problemet kan løses ved at introducere en model, der bærer gassens karakteristiske egenskaber, og fjerner kompleksiteten af interaktionen.
Ideel gas er en stoftilstand, hvor vekselvirkningen mellem partikler er ubetydelig, den potentielle vekselvirkningsenergi har en tendens til nul. Kun bevægelsesenergien, som afhænger af partiklernes hastighed, kan betragtes som signifikant.
Ideelt gastryk
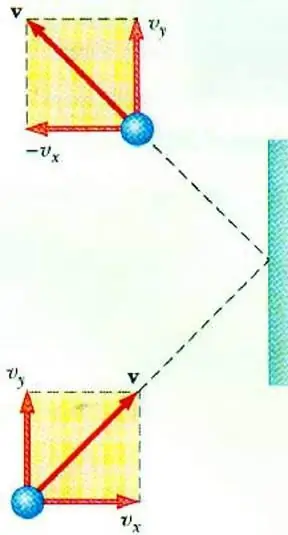
At afsløre forholdet mellem gastryk og hastigheden af dens partikler tillader den grundlæggende ligning af MKT for en ideel gas. En partikel, der bevæger sig i et kar, overfører ved anslag med væggen en impuls til den, hvis værdi kan bestemmes på grundlag af den anden lovNewton:
F∆t=2m0vx
Ændring i en partikels momentum under elastisk stød er forbundet med en ændring i den vandrette komponent af dens hastighed. F er kraften, der virker fra siden af partiklen på væggen i en kort tid t; m0 – partikelmasse.
Alle gaspartikler kolliderer med overfladen af området S i løbet af tiden ∆t, bevæger sig i overfladens retning med hastigheden vx og er placeret i en cylinder med volumen Sυ x Δt. Ved partikelkoncentration n bevæger nøjagtig halvdelen af molekylerne sig mod væggen, den anden halvdel bevæger sig i den modsatte retning.
Efter at have overvejet kollisionen af alle partikler, kan vi skrive Newtons lov for den kraft, der virker på området:
F∆t=nm0vx2S∆t
Da gastryk er defineret som forholdet mellem kraften, der virker vinkelret på overfladen og arealet af sidstnævnte, kan vi skrive:
p=F: S=nm0vx2
Den resulterende relation som den grundlæggende ligning for MKT kan ikke beskrive hele systemet, da kun én bevægelsesretning tages i betragtning.
Maxwell distribution
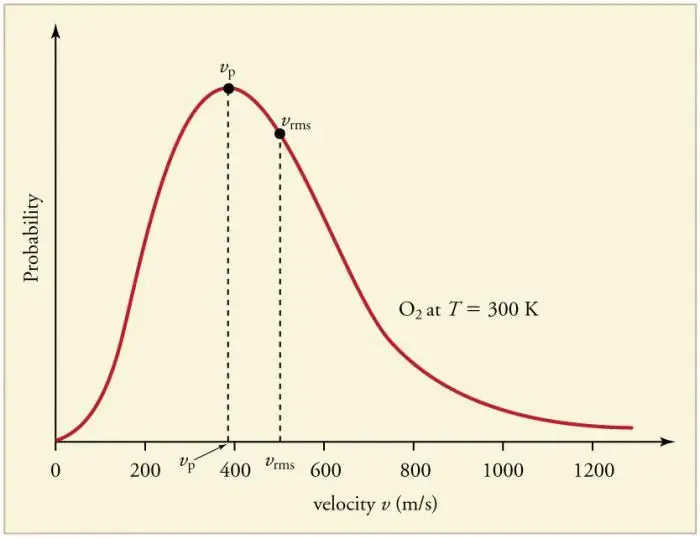
Kontinuerlige hyppige kollisioner af gaspartikler med væggene og med hinanden fører til etablering af en vis statistisk fordeling af partikler i form af hastigheder (energier). Retningen af alle hastighedsvektorer viser sig at være lige sandsynlige. Denne fordeling kaldes Maxwell-fordelingen. I 1860 var dette mønsterudledt af J. Maxwell på grundlag af MKT. Fordelingslovens hovedparametre kaldes hastigheder: sandsynlige, svarende til kurvens maksimale værdi, og rod-middel-kvadrat vkv=√‹v2 › - middelkvadrat for partikelhastigheden.
Forøgelse i gastemperatur svarer til stigning i hastighed.
Baseret på det faktum, at alle hastigheder er ens, og deres moduler har samme værdi, kan vi antage:
‹v2›=‹vx2› + ‹v y2› + ‹vz2›, fra: ‹ vx2›=‹v2›: 3
Den grundlæggende ligning for MKT, under hensyntagen til den gennemsnitlige værdi af gastrykket, er:
p=nm0‹v2›: 3.
Dette forhold er unikt ved, at det bestemmer forholdet mellem mikroskopiske parametre: hastighed, partikelmasse, partikelkoncentration og gastryk generelt.
Ved at bruge begrebet partiklers kinetiske energi kan den grundlæggende ligning for MKT omskrives anderledes:
p=2nm0‹v2›: 6=2n‹Ek›: 3
En gass tryk er proportional med gennemsnitsværdien af dens partiklers kinetiske energi.
Temperatur
Interessant nok, for en konstant mængde gas i en lukket beholder, kan man relatere gastrykket og den gennemsnitlige værdi af partikelbevægelsesenergien. I dette tilfælde kan trykket måles ved at måle energienpartikler.
Hvad skal jeg gøre? Hvilken værdi kan sammenlignes med kinetisk energi? Temperaturen viser sig at være sådan en værdi.

Temperatur er et mål for stoffers termiske tilstand. For at måle det bruges et termometer, hvis grundlag er den termiske udvidelse af arbejdsvæsken (alkohol, kviksølv), når den opvarmes. Termometerskalaen er lavet eksperimentelt. Norm alt anbringes der mærker på det, der svarer til arbejdsvæskens position under en fysisk proces, der finder sted ved en konstant termisk tilstand (kogende vand, smeltende is). Forskellige termometre har forskellige skalaer. F.eks. Celsius, Fahrenheit.

Universal temperaturskala
Gastermometre kan betragtes som mere interessante med hensyn til uafhængighed af arbejdsvæskens egenskaber. Deres skala afhænger ikke af den anvendte type gas. I en sådan anordning kan man hypotetisk udskille den temperatur, ved hvilken gastrykket har en tendens til nul. Beregninger viser, at denne værdi svarer til -273,15 oC. Temperaturskalaen (absolut temperaturskala eller Kelvin-skala) blev introduceret i 1848. Den mulige temperatur på nul gastryk blev taget som hovedpunktet på denne skala. Et enhedssegment af skalaen er lig med en enhedsværdi af Celsius-skalaen. Det virker mere bekvemt at nedskrive den grundlæggende MKT-ligning ved hjælp af temperatur, når man studerer gasprocesser.
Forholdet mellem tryk og temperatur
Empirisk kan du bekræfte detgastrykkets proportionalitet med dens temperatur. Samtidig blev det fundet, at trykket er direkte proportion alt med koncentrationen af partikler:
P=nkT,
hvor T er absolut temperatur, k er en konstant lig med 1,38•10-23J/K.
Den fundamentale værdi, som har en konstant værdi for alle gasser, kaldes Boltzmann-konstanten.
Sammenligner trykkets afhængighed af temperaturen og den grundlæggende ligning for MKT-gasserne, kan vi skrive:
‹Ek›=3kT: 2
Den gennemsnitlige værdi af den kinetiske energi af gasmolekylers bevægelse er proportional med dens temperatur. Det vil sige, at temperaturen kan tjene som et mål for den kinetiske energi af partikelbevægelse.






