En vigtig del af termodynamikken er studiet af transformationer mellem forskellige faser af et stof, da disse processer forekommer i praksis og er af fundamental betydning for at forudsige et systems adfærd under visse forhold. Disse transformationer kaldes faseovergange, som artiklen er dedikeret til.
Begrebet en fase og en systemkomponent

Før man går videre til overvejelserne om faseovergange i fysik, er det nødvendigt at definere begrebet selve fasen. Som det er kendt fra den almene fysik, er der tre tilstande af stof: gasformig, fast og flydende. I en særlig del af videnskaben - i termodynamikken - er lovene formuleret for stoffets faser, og ikke for deres aggregeringstilstande. En fase forstås som et bestemt volumen stof, der har en homogen struktur, er karakteriseret ved specifikke fysiske og kemiske egenskaber og er adskilt fra resten af stof af grænser, som kaldes interfase.
Begrebet "fase" indeholder således meget mere praktisk betydningsfuld information om ejendommenestof end dens aggregeringstilstand. For eksempel kan den faste tilstand af et metal såsom jern være i følgende faser: lavtemperatur magnetisk kropscentreret kubisk (BCC), lavtemperatur ikke-magnetisk bcc, ansigtscentreret kubisk (fcc) og høj- temperatur ikke-magnetisk bcc.
Ud over begrebet "fase" bruger termodynamikkens love også udtrykket "komponenter", som betyder antallet af kemiske grundstoffer, der udgør et bestemt system. Det betyder, at fasen kan være enten monokomponent (1 kemisk grundstof) eller multikomponent (flere kemiske grundstoffer).
Gibbs' sætning og ligevægt mellem faser af systemet

For at forstå faseovergange er det nødvendigt at kende ligevægtsbetingelserne mellem dem. Disse betingelser kan opnås matematisk ved at løse systemet af Gibbs-ligninger for hver af dem, idet det antages, at ligevægtstilstanden nås, når den samlede Gibbs-energi i systemet isoleret fra ydre påvirkning holder op med at ændre sig.
Som et resultat af løsning af det angivne ligningssystem opnås betingelser for eksistensen af ligevægt mellem flere faser: et isoleret system vil kun ophøre med at udvikle sig, når trykkene, kemiske potentialer for hver komponent og temperaturer i alle faser er lig med hinanden.
Gibbs faseregel for ligevægt

Et system bestående af flere faser og komponenter kan ikke kun være i ligevægtunder visse forhold, for eksempel ved en bestemt temperatur og tryk. Nogle af variablerne i Gibbs-sætningen for ligevægt kan ændres, mens både antallet af faser og antallet af komponenter, der er i denne ligevægt, bevares. Antallet af variable, der kan ændres uden at forstyrre ligevægten i systemet, kaldes antallet af friheder i dette system.
Antallet af friheder l i et system bestående af f faser og k komponenter er entydigt bestemt ud fra Gibbs fasereglen. Denne regel er matematisk skrevet som følger: l + f=k + 2. Hvordan arbejder man med denne regel? Meget simpelt. For eksempel er det kendt, at systemet består af f=3 ligevægtsfaser. Hvad er det mindste antal komponenter et sådant system kan indeholde? Du kan besvare spørgsmålet ved at ræsonnere som følger: i tilfælde af ligevægt eksisterer de mest stringente betingelser, når det kun realiseres ved visse indikatorer, det vil sige, at en ændring i enhver termodynamisk parameter vil føre til ubalance. Det betyder, at antallet af friheder l=0. Ved at erstatte de kendte værdier af l og f får vi k=1, det vil sige, at et system, hvor tre faser er i ligevægt, kan bestå af en komponent. Et godt eksempel er vands tredobbelte punkt, hvor is, flydende vand og damp eksisterer i ligevægt ved specifikke temperaturer og tryk.
Klassificering af fasetransformationer
Hvis du begynder at ændre nogle termodynamiske parametre i et system i ligevægt, kan du observere, hvordan en fase vil forsvinde, og en anden vil dukke op. Et simpelt eksempel på denne proces er smeltning af is, når den opvarmes.
I betragtning af at Gibbs-ligningen kun afhænger af to variable (tryk og temperatur), og faseovergangen involverer en ændring i disse variable, så matematisk kan overgangen mellem faser beskrives ved at differentiere Gibbs-energien med hensyn til dens variabler. Det var denne tilgang, der blev brugt af den østrigske fysiker Paul Ehrenfest i 1933, da han kompilerede en klassifikation af alle kendte termodynamiske processer, der opstår med en ændring i faseligevægt.
Af det grundlæggende i termodynamikken følger det, at den første afledte af Gibbs-energien med hensyn til temperatur er lig med ændringen i systemets entropi. Den afledte af Gibbs energi med hensyn til tryk er lig med ændringen i volumen. Hvis, når faserne i systemet ændrer sig, entropien eller volumen lider af et brud, dvs. de ændrer sig brat, så taler de om en førsteordens faseovergang.
Yderligere er den anden afledte af Gibbs-energien med hensyn til temperatur og tryk henholdsvis varmekapaciteten og den volumetriske udvidelseskoefficient. Hvis transformationen mellem faser er ledsaget af en diskontinuitet i værdierne af de angivne fysiske størrelser, så taler man om en andenordens faseovergang.
Eksempler på transformationer mellem faser

Der er et stort antal forskellige overgange i naturen. Inden for rammerne af denne klassifikation er slående eksempler på overgange af den første slags processerne med smeltning af metaller eller kondensering af vanddamp fra luft, når der er et volumenspring i systemet.
Hvis vi taler om andenordens overgange, så er slående eksempler transformationen af jern fra en magnetisk til en paramagnetisk tilstand ved en temperatur768 ºC eller transformation af en metallisk leder til en superledende tilstand ved temperaturer tæt på det absolutte nulpunkt.
Ligninger, der beskriver overgange af den første slags
I praksis er det ofte nødvendigt at vide, hvordan temperaturen, trykket og absorberet (frigivet) energi ændrer sig i et system, når der sker fasetransformationer i det. To vigtige ligninger bruges til dette formål. De opnås baseret på viden om det grundlæggende inden for termodynamik:
- Clapeyrons formel, som fastslår forholdet mellem tryk og temperatur under transformationer mellem forskellige faser.
- Clausius-formel, der forbinder den absorberede (frigivne) energi og systemets temperatur under transformationen.
Brugen af begge ligninger er ikke kun til at opnå kvantitative afhængigheder af fysiske størrelser, men også til at bestemme tegnet for hældningen af ligevægtskurver på fasediagrammer.
Ligning til beskrivelse af overgange af anden art

Faseovergange af 1. og 2. art beskrives med forskellige ligninger, da anvendelsen af Clausius- og Clausius-ligningerne for andenordens overgange fører til matematisk usikkerhed.
Til at beskrive sidstnævnte anvendes Ehrenfest-ligningerne, som etablerer en sammenhæng mellem ændringer i tryk og temperatur gennem viden om ændringer i varmekapacitet og volumetrisk udvidelseskoefficient under transformationsprocessen. Ehrenfest-ligningerne bruges til at beskrive leder-superleder-overgange i fravær af et magnetfelt.
Betydningfasediagrammer
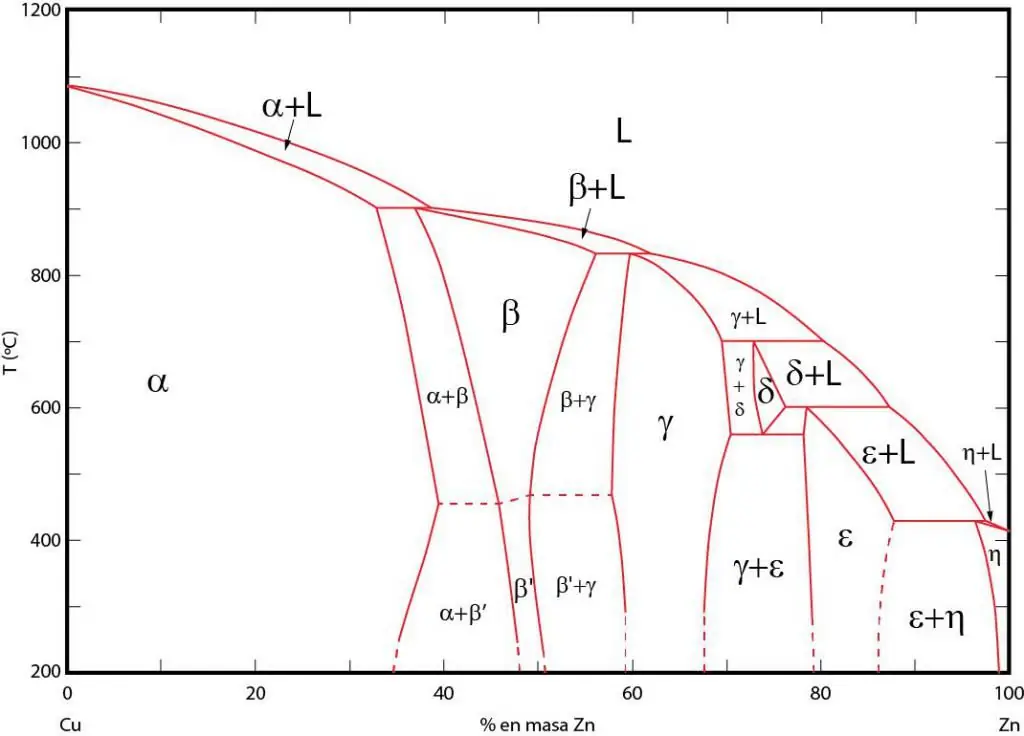
Fasediagrammer er en grafisk repræsentation af områder, hvor de tilsvarende faser eksisterer i ligevægt. Disse områder er adskilt af ligevægtslinjer mellem faserne. P-T (tryk-temperatur), T-V (temperatur-volumen) og P-V (tryk-volumen) fasediagrammer bruges ofte.
Vigtigheden af fasediagrammer ligger i, at de giver dig mulighed for at forudsige, hvilken fase systemet vil være i, når de eksterne forhold ændrer sig tilsvarende. Disse oplysninger bruges i varmebehandlingen af forskellige materialer for at opnå en struktur med ønskede egenskaber.






