Kendskab til definitioner i fysik er en nøglefaktor for succesfuld løsning af forskellige fysiske problemer. I artiklen vil vi overveje, hvad der menes med isobariske, isochoriske, isotermiske og adiabatiske processer for et ideelt gassystem.
Ideel gas og dens ligning
Før vi går videre til beskrivelsen af isobariske, isokoriske og isotermiske processer, lad os overveje, hvad en ideel gas er. Under denne definition i fysik betragter de et system bestående af et stort antal dimensionsløse og ikke-interagerende partikler, der bevæger sig med høje hastigheder i alle retninger. Faktisk taler vi om en gasformig aggregattilstand af stof, hvor afstandene mellem atomer og molekyler langt overstiger deres størrelser, og hvor den potentielle energi for vekselvirkning af partikler negligeres på grund af dens lillehed sammenlignet med den kinetiske energi.
Tilstanden af en ideel gas er helheden af dens termodynamiske parametre. De vigtigste er temperatur, volumen og tryk. Lad os betegne dem med henholdsvis bogstaverne T, V og P. I 30'erne af XIX århundredeClapeyron (en fransk videnskabsmand) skrev først en ligning, der kombinerer de angivne termodynamiske parametre inden for en enkelt lighed. Det ser ud som:
PV=nRT,
hvor n og R er henholdsvis mængden af stoffer og gaskonstanten.
Hvad er isoprocesser i gasser?
Som mange har bemærket, bruger isobariske, isokoriske og isotermiske processer det samme "iso"-præfiks i deres navne. Det betyder ligheden mellem en termodynamisk parameter under hele processen, mens de resterende parametre ændres. For eksempel indikerer en isoterm proces, at systemets absolutte temperatur som et resultat holdes konstant, mens en isokorisk proces indikerer et konstant volumen.
Isoprocesser er praktiske at studere, da fastsættelse af en af de termodynamiske parametre fører til en forenkling af den generelle ligning for gastilstand. Det er vigtigt at bemærke, at gaslovene for alle disse isoprocesser blev opdaget eksperimentelt. Deres analyse gjorde det muligt for Clapeyron at opnå den reducerede universelle ligning.
Isobariske, isokoriske og isotermiske processer
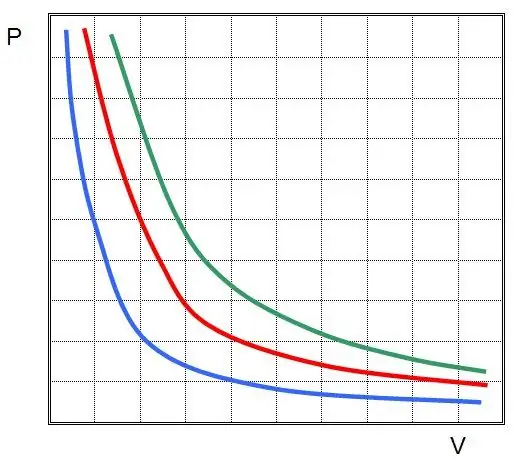
Den første lov blev opdaget for en isoterm proces i en ideel gas. Nu hedder det Boyle-Mariotte-loven. Da T ikke ændres, indebærer tilstandsligningen ligheden:
PV=konst.
Med andre ord fører enhver trykændring i systemet til en omvendt proportional ændring i dets volumen, hvis gassens temperatur holdes konstant. Grafen for funktionen P(V) erhyperbole.
Isobarisk proces - dette er en ændring i systemets tilstand, hvor trykket forbliver konstant. Efter at have fastsat værdien af P i Clapeyron-ligningen, opnår vi følgende lov:
V/T=konst.
Denne lighed bærer navnet på den franske fysiker Jacques Charles, som modtog den i slutningen af det 18. århundrede. Isobaren (grafisk gengivelse af V(T)-funktionen) ligner en ret linje. Jo mere tryk i systemet, jo hurtigere stiger denne linje.
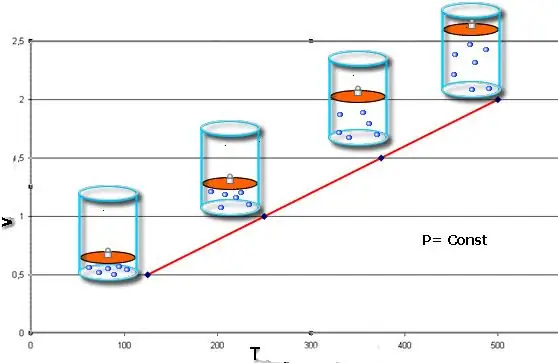
Den isobariske proces er nem at implementere, hvis gassen opvarmes under stemplet. Sidstnævntes molekyler øger deres hastighed (kinetisk energi), skaber et højere tryk på stemplet, hvilket fører til udvidelse af gassen og opretholdelse af en konstant værdi på P.
Endelig er den tredje isoproces isokorisk. Den kører med konstant volumen. Fra tilstandsligningen får vi den tilsvarende lighed:
P/T=konstant.
Det er kendt blandt fysikere som Gay-Lussacs lov. Den direkte proportionalitet mellem tryk og absolut temperatur indikerer, at grafen for den isobariske proces, ligesom grafen for den isobariske proces, er en ret linje med en positiv hældning.
Det er vigtigt at forstå, at alle isoprocesser forekommer i lukkede systemer, det vil sige, at værdien af n bevares under deres forløb.
Adiabatisk proces
Denne proces hører ikke til "iso"-kategorien, da alle tre termodynamiske parametre ændres under dens passage. adiabatiskkaldet overgangen mellem to tilstande i systemet, hvor det ikke udveksler varme med omgivelserne. Udvidelsen af systemet udføres således på grund af dets interne energireserver, hvilket fører til et betydeligt fald i tryk og absolut temperatur i det.
Adiabatisk proces for en ideel gas beskrives af Poissons ligninger. En af dem er vist nedenfor:
PVγ=const,
hvor γ er forholdet mellem varmekapaciteter ved konstant tryk og ved konstant volumen.
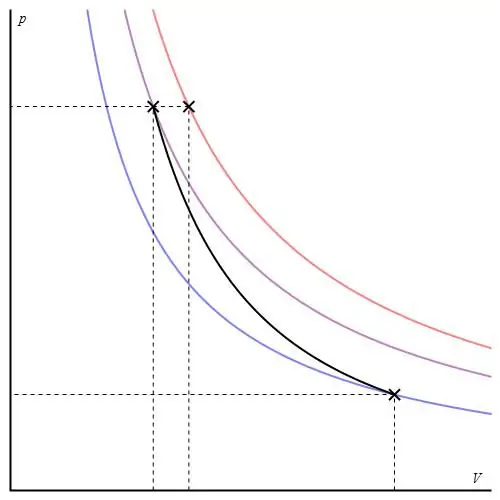
Den adiabatiske graf adskiller sig fra den isokoriske procesgraf og fra den isobariske graf, men den ligner en hyperbel (isoterm). Adiabaten i P-V-akserne opfører sig skarpere end isotermen.






